習慣性流産 概念と適応の最新基準
概念と適応の最新基準
定義の更新: 従来は3回以上の流産を「習慣性流産」と呼んでいましたが、現在は**2回以上の流産(反復流産)**から積極的な検査・介入の対象とされます。(ASRM・ESHREでは「2回以上」、日本産科婦人科学会も近年は2回以上を重視)
生児の有無を問わない: 過去に出産経験があっても、その後に流産が続く場合は不育症として扱います。
基本検査(スクリーニング)
エビデンスの確立された標準検査
|
分類 |
検査項目 |
臨床的意義 |
|
夫婦染色体 |
夫婦の末梢血G-banding法 |
均衡型転座、ロバートソン転座の有無を確認。 |
|
子宮形態 |
3D経腟超音波、子宮卵管造影(HSG) |
中隔子宮、双角子宮、単角子宮、粘膜下筋腫などの検出。 |
|
内分泌 |
TSH, FT4, HbA1c, プロラクチン |
甲状腺機能異常(潜在性含む)、糖尿病、高PRL血症の除外。 |
|
抗リン脂質抗体(APS) |
LA(ループスAC)、aCL $\beta_2$GP-I、aCL IgG/IgM |
血栓形成リスクの評価。3-6ヶ月間隔での2回陽性で確定。 |
|
凝固因子 |
第XII因子、プロテインS/C活性 |
血液凝固阻止因子の欠乏確認。 |
夫婦染色体 G-banding
検査手法:G-banding法(G分染法)
方法: 末梢血から抽出したリンパ球を培養し、細胞分裂中期(メタフェーズ)で停止させ、ギムザ染色を施して顕微鏡下で解析します。
解像度: 通常400〜550バンドの解像度で観察します。
目的: 染色体の「数」の異常だけでなく、顕微鏡で捉えられるレベルの「構造」の異常(転座、欠失、逆位など)を同定します。
習慣性流産(不育症)の原因として最も頻度の高い遺伝学的要因である「染色体構造異常」について、以下解説します。
1. 均衡型相互転座 (Balanced Reciprocal Translocation)
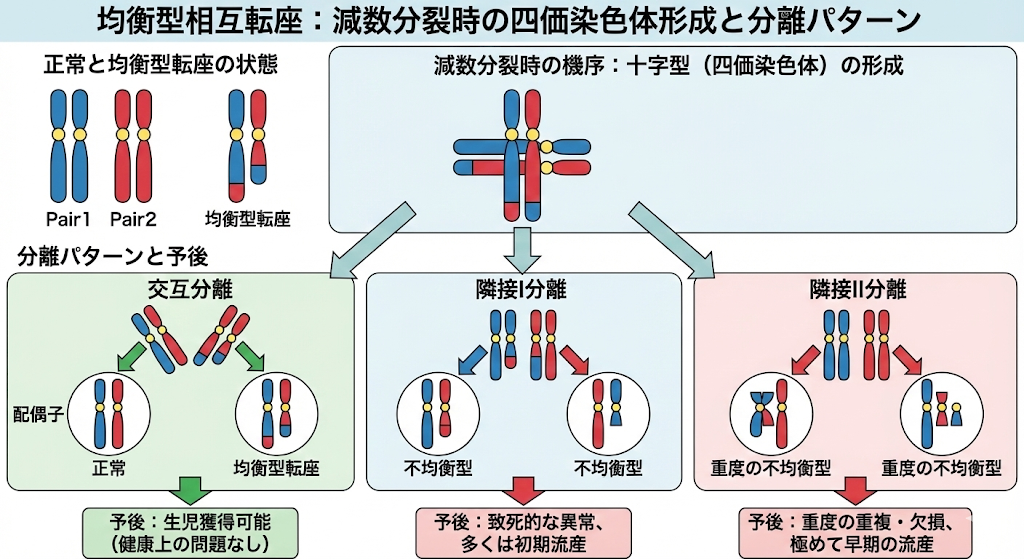
均衡型相互転座 (Balanced Reciprocal Translocation)
2本の異なる染色体の間で、染色体断片が相互に入れ替わった状態を指します。
全体として遺伝情報の過不足はないため、保因者本人は通常、身体的・知的な異常を示しません。
減数分裂の機序(十字型形成)
通常、減数分裂では同じ番号の染色体(相同染色体)がペアになりますが、転座がある場合は、対応する部位を探して**4本の染色体が十字型(四価染色体)**に集まります。この十字からの分かれ方(分離)によって、配偶子の運命が決まります。
分離パターンと予後
- 交互分離 (Alternate):
十字の対角線上の染色体がセットで分かれます。
結果:正常 または 親と同じ均衡型転座。
予後:いずれも遺伝情報の過不足がなく生児獲得が可能で、健康上の問題はありません。 - 隣接I分離 (Adjacent-1):
隣り合う染色体が分かれますが、中心体(セントロメア)は相同なものが別々の細胞へ行きます。
結果:一部が重複し、一部が欠損した不均衡型。
予後:致死的な異常となり、多くは初期流産に至ります。 - 隣接II分離 (Adjacent-2):
相同な中心体が同じ細胞へ行ってしまう極めて稀なケースです。
結果:重度の重複と欠損。
予後:極めて早期の流産となります。
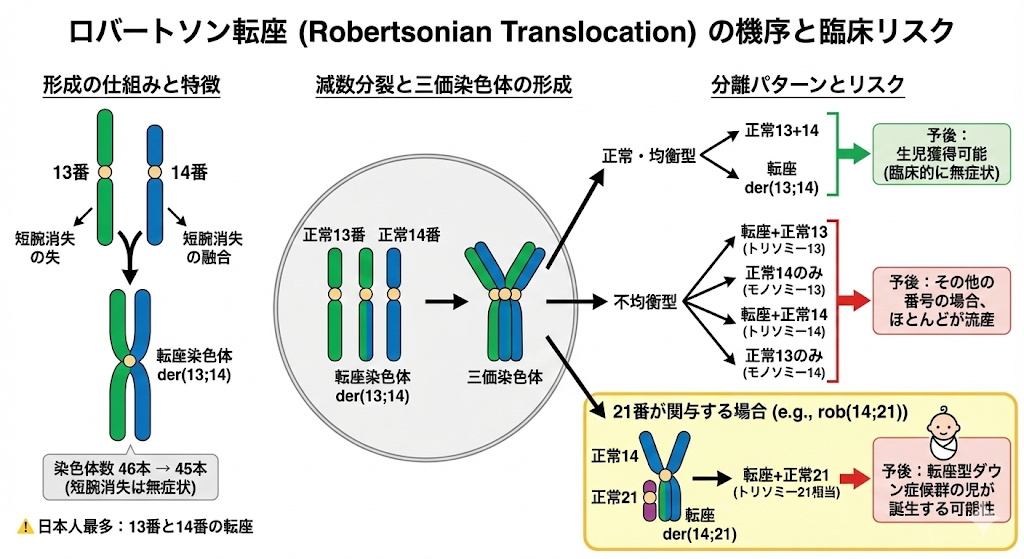
2. ロバートソン転座 (Robertsonian Translocation)
13, 14, 15, 21, 22番のような「末端に中心体がある染色体」同士が、長腕でくっついて1本になった状態です。
特徴
染色体数は45本になりますが、短腕の消失は臨床的に無症状です。
日本人に最も多いのは 13番と14番の転座 です。
減数分裂とリスク
減数分裂時には、転座した1本と、正常な2本の計3本が集まり、三価染色体を形成します。
21番が関与する場合: 21番が1本多くなる「転座型ダウン症候群」の児が誕生する可能性があります。
その他の番号の場合: ほとんどの不均衡型は流産となります。
3. 臨床におけるカウンセリングと治療
臨床におけるカウンセリングと治療戦略
夫婦のいずれかに転座が見つかった場合、専門医は以下の3点を中心にマネジメントを行います。
① 累積生児獲得率の提示
「転座=子供ができない」ではありません。
自然妊娠を繰り返した場合、不均衡型は流産しますが、交互分離(正常または均衡型)が起きた際に生児を得られます。
**最終的な生児獲得率は70%〜80%**に達するというエビデンスを提示し、心理的な負担を軽減します。
② PGT-SR (着床前胚染色体構造異常検査)
体外受精を行い、移植前に胚の染色体を調べる選択肢です。
メリット: 流産率を劇的に下げ(約10%以下)、妊娠までの期間を短縮できます。
留意点: 正常胚(または均衡型胚)が得られない周期もあり、コストと身体的負担のバランスを考慮する必要があります。
③ 遺伝カウンセリング
次子への遺伝の可能性や、家系内(兄弟姉妹など)への情報共有の是非について、臨床遺伝専門医や認定遺伝カウンセラーによるサポートが推奨されます。
凝固異常の評価
習慣性流産(不育症)の診療において、凝固異常の評価は最もエビデンスが確立されており、かつ治療介入による生児獲得率の向上が顕著な分野です。 以下、各因子の詳細な臨床的意義と診断のポイントを解説します。
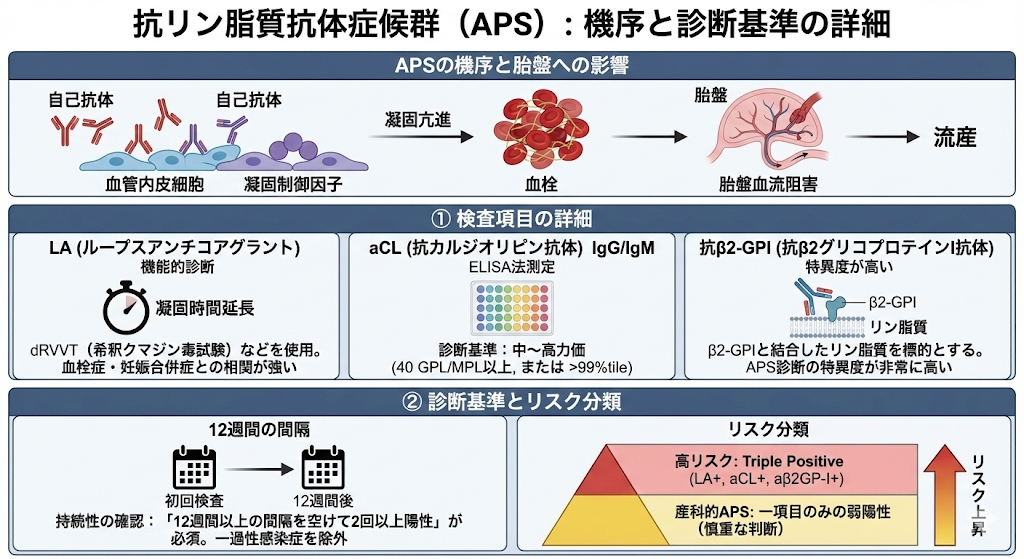
抗リン脂質抗体症候群(antiphospholipid syndrome, APS)
原発性抗リン脂質抗体症候群(指定難病48) – 難病情報センター
抗カルジオリピン抗体、ループス抗凝固因子(LAC)などの抗リン脂質抗体陽性と、血栓症や妊娠合併症が合致する状態をAPSと呼びます。
主な症状:下肢深部静脈血栓、肺塞栓、脳梗塞、習慣流産(特に妊娠中期以降の胎児死亡)などが代表的です。
APSは、自己抗体が血管内皮や凝固制御因子に作用し、凝固亢進と血栓形成を促すと考えられています(β2‑GPI阻害、プロテインC系の抑制など)、胎盤血流が阻害されることで流産を引き起こします。診断には「国際診断基準(改訂札幌基準/シドニー基準)」を用います。
① 検査項目の詳細
LA(ループスアンチコアグラント): * 血液の凝固時間を測定する「機能的診断」です。リン脂質依存性の凝固延長を確認します。
**dRVVT(希釈クマジン毒試験)**などが用いられ、3つの指標の中で最も血栓症や妊娠合併症との相関が強いとされています。
aCL(抗カルジオリピン抗体)IgG/IgM:
ELISA法で測定。中〜高力価(40 GPL/MPL以上、または99パーセンタイル以上)が診断基準となります。
抗β2‑GPI (抗$\beta_2$グリコプロテインI抗体):
抗β2‑GPIというタンパク質と結合したリン脂質を標的とする抗体です。APS診断の特異度が非常に高いのが特徴です。
② 「12週間(3-6ヶ月)の間隔」の意味
一過性の感染症などでもこれらの抗体は陽性になることがあります。
持続性の確認: 診断基準では**「12週間以上の間隔を空けて2回以上陽性」**であることが必須です。
リスク分類: 全てが陽性の「Triple positive(LA+, aCL+, a$\beta_2$GP-I+)」は最もリスクが高く、逆に一項目のみの弱陽性は「Obstetric APS(産科的APS)」として慎重な判断が求められます。
凝固因子の評価(第XII因子、プロテインS/C)
先天的な凝固阻止因子の欠乏や異常は、胎盤内の微小血栓形成を誘発します。
① 第XII因子(Hageman因子)
- 日本独自の重要性: 国際的には議論がありますが、日本では習慣性流産との関連が深く、不育症スクリーニングの標準項目です。
- 臨床的意義: 第XII因子は内因系凝固の開始に関与しますが、欠乏すると逆に線溶系(血栓を溶かす仕組み)が低下し、相対的に血栓形成傾向となります。
- 基準値: 60%未満を低下と判断することが多く、重度の欠乏は治療対象となります。
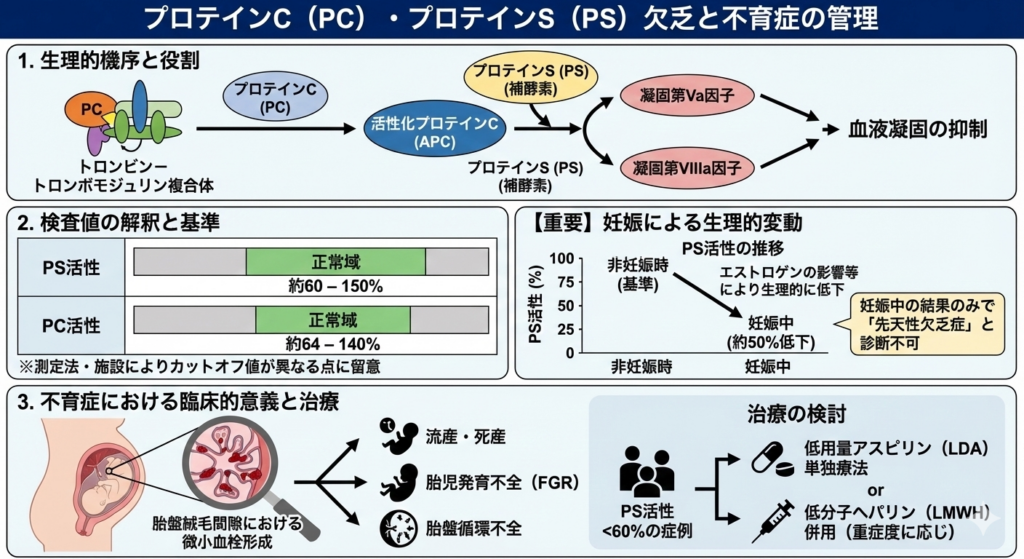
② プロテインC(PC)・プロテインS(PS)欠乏と不育症の管理
- 生理的機序と役割
プロテインC(PC)は、トロンビン−トロンボモジュリン複合体により活性化(APC)されると、凝固第V因子および第VIII因子を限定分解し、血液凝固を抑制します。プロテインS(PS)はこの反応においてAPCの補酵素(Cofactor)として機能し、抗凝固作用を増強します。
- 検査値の解釈と基準
日本の不育症診療指針において、以下の基準が一般的ですが、測定法や施設によりカットオフ値が異なる点に留意が必要です。
|
項目 |
正常域(目安) |
備考 |
|
PS活性 |
約60 – 150% |
活性測定(合成基質法・凝固時間法)が一般的 |
|
PC活性 |
約64 – 140% |
欠乏症は血栓傾向(Thrombophilia)の指標 |
【重要】妊娠による生理的変動
妊娠中はエストロゲンの影響等により、PS活性が非妊娠時の約50%程度まで生理的に低下します。そのため、妊娠中の検査結果のみで「先天性欠乏症」と診断することはできません。
- 不育症における臨床的意義
先天性のPS/PC欠乏は、母体血栓症のリスクを高めるだけでなく、胎盤絨毛間隙における微小血栓形成を誘発し、胎盤循環不全から流産・死産・胎児発育不全(FGR)の原因となります。
- 治療の検討: 臨床的には、PS活性が60%未満の症例において流産率の上昇が報告されており、低用量アスピリン(LDA)単独療法、または重症度に応じた低分子ヘパリン(LMWH)の併用が検討されます。
- エビデンス: 介入による生児獲得率の向上については、施設間や症例背景により議論がありますが、血栓素因を有する不育症管理において標準的な選択肢の一つとなっています。
検査結果に基づき、階層的治療
|
診断結果 |
推奨される治療法 |
|
確定的APS (基準を満たす) |
低用量アスピリン(LDA) + 低分子ヘパリン(LMWH) ※ヘパリンは自己注射で妊娠判明直後〜分娩前まで。 |
|
第XII因子 / PS・PC欠乏 |
低用量アスピリン(LDA)単独 または LDA + ヘパリン(重症度による) |
|
抗体弱陽性 (基準未満) |
低用量アスピリン(LDA)のみで経過観察することも多い。 |
其の他・選択的精密検査
基本検査で原因不明(約50%以上)とされた症例や、難治性症例に対して行われる最新の精密検査です。
① ネオセルフ抗体(抗$\beta_2$GP-I/HLA-DR複合体抗体)
概要: 神戸大学の研究により発見された新しい自己抗体。従来のAPS検査では陰性となる症例の約20%で陽性となります。 陽性例には低用量アスピリン・ヘパリン療法が有効であることが示されています。
② 流産検体染色体検査(POC-test / NGS法)
概要: 流産した組織の染色体を次世代シーケンサー(NGS)で解析します。
意義: 「胎児側の偶発的なエラー」か「母体側のリスク因子」かを切り分ける最も重要な検査です。胎児正常染色体での流産が続く場合、より強力な母体治療が必要です。
③ 慢性子宮内膜炎(CE)と内膜マイクロバイオーム
CD138免疫染色: 子宮内膜の形質細胞を同定。不育症患者の約30〜50%に認められ、流産リスクを上昇させます。
EMMA/ALICE検査: 子宮内の乳酸菌割合と病原菌(内膜炎原因菌)を遺伝子レベルで特定します。
④ 男性因子(精子DNA断片化指数: DFI)
概要: 精子外見が正常でも、内部のDNAが損傷している割合(DFI)が高いと、受精卵の質が低下し流産率が上がることが判明しています。
